Hemoglobina y Hemo
La molécula de hemoglobina está formada por cuatro cadenas polipeptídicas (alfa1, beta1, alfa2 y beta2), unidas entre sí de forma no covalente. Por cada molécula de hemoglobina hay además cuatro moléculas de hemo.
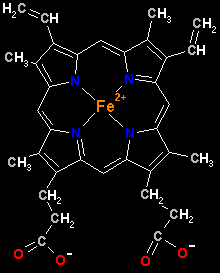
Cada cadena contiene un grupo hemo (una molécula de protoporfirina IX complejada con un átomo de Fe++).
Los grupos hemo se representan en rojo porque son los responsables del color rojo de la hemoglobina.
Ahora los grupos hemo se colorean utilizando el código CPK. (Los átomos de hidrógeno no se representan). La molécula de oxígeno se une al Fe2+ del hemo en los pulmones, donde el oxígeno es abundante, y se libera en los tejidos que necesitan el oxígeno para su metabolismo.

Aquí podemos ver en detalle una única molécula de hemo (intente identificar los sustituyentes del anillo porfirínico).
El Fe2+ del hemo puede formar 6 enlaces de coordinación.
Cuatro de ellos, situados en el plano del hemo, se establecen con los nitrógenos de los anillos pirrólicos de la protoporfirina IX.
Los otros dos, perpendiculares al plano del hemo, se establecen con el nitrógeno de la cadena lateral de la histidina F8 (histidina proximal) y con el oxígeno.
A la misma cara del hemo a la que se une el oxígeno se aproxima la cadena lateral de la histidina E7 (histidina distal), que aunque no establece enlace con el Fe2+ dificulta estéricamente la unión del CO al sitio del oxígeno.
La afinidad del hemo aislado por el CO es 25000 veces la del oxígeno, mientras que en la hemoglobina es sólo 200 veces mayor.
Aquí se muestra la posición de la molécula de hemo (con una molécula de oxígeno) en una de las cuatro cadenas de la hemoglobina, representada en un modelo compacto. Los residuos de propionato del hemo (hidrofílicos) se disponen hacia la superficie de la proteína, mientras que el resto de la molécula (hidrofóbica) queda enterrada entre los aminoácidos apolares de la proteína, y las dos histidinas (F8 y E7).